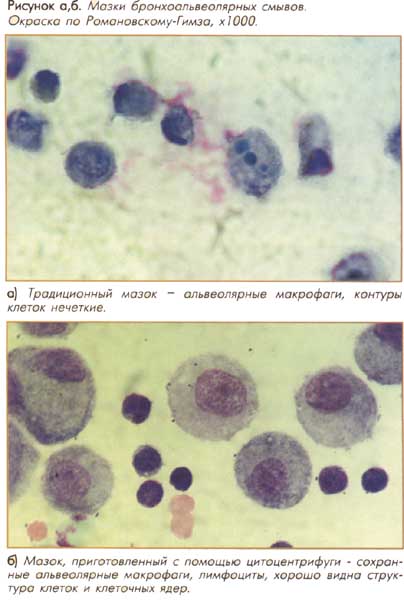
Стандартные цитопрепараты бронхоальвеолярного лаважа в исследовании и патологии легких.
Бронхоальвеолярный лаваж (БАЛ) - полезный и эффективный метод получения диагностической информации при патологии легких. Клеточный состав бронхоальвеолярных смывов (БАС) позволяет проводить дифференциальную диагностику болезней легких, оценить эффективность проводимого лечения. Значение БАЛ в современной диагностике высоко при злокачественных опухолях, альвеолярном протеинозе, респираторных инфекциях, воздействии различных пылей и минералов, интерстициальных заболеваниях легких (1). Чтобы исследование было информативно, необходимо правильно получить БАС и подготовить его для анализа. В настоящей работе сравниваются мазки, приготовленные традиционным методом и с помощью цитоцентрифуги, при исследовании патологии легких.
Методика подготовки БАС для исследования.
БАС получают
под местной или общей анестезией при проведении фибробронхоскопии. При выполнении БАЛ
вводят сначала 50 мл стерильного забуференного физиологического
раствора с последующей его
аспирацией, что составляет
бронхиальную порцию лаважа (или бронхиальный
смыв). Затем вводят еще 150-200 мл,
дробно по 50 мл, последовательно аспирируя жидкость, которая и
составляет собственно БАС. Лаважная жидкость должна
быть собрана в химически чистую
пластиковую или силиконированную посуду, чтобы
исключить прилипание клеток к
стенкам посуды. Жидкость охлаждают
на льду, фильтруют через 4 слоя
марли. Клеточную суспензию
отмывают 2 раза в сбалансированном
солевом растворе Хенкса или 199 культуральной среде,
центрифугируют в течение 10 минут
при 1000 об/мин. В камере Горяева определяют
количество клеток в 1 мл БАС и их
жизнеспособность. Для этого к 950 мкл 0.1% раствора
водорастворимого эозина в двойном
растворе Рингера добавляют равное
количество 0.1 % водного раствора трипанового синего. Исходные
растворы красителей следует
хранить при 4°С. Рабочие растворы
готовят ex tempore. К полученному
раствору красителя добавляют 100 мкл
клеточной взвеси и ресуспендируют. Затем вносят
окрашенный раствор в камеру
Горяева. Определяют процент
жизнеспособных клеток, при этом
жизнеспособными считают абсолютно
бесцветные клетки.
Жизнеспособность следует
определять в первые 3 минуты после
внесения жидкости в камеру. Затем
проводят подсчет количества клеток
в 5 больших квадратах, что
соответствует их количеству в 1 мл
клеточной суспензии. Для
определения цитоза пересчитывают
количество клеток на 1 мл БАС.
Использование цитоцентрифуги (2, 3) позволяет приготовить качественные мазки с монослоем клеток (рис. а, б). Для приготовления мазков с определенной плотностью клеточных элементов на единицу площади необходимо рассчитать требуемое число клеток. Для оценки БАС оптимальная концентрация составляет 200 тыс. клеток в 1 мл клеточной суспензии. Для приготовления мазка используют 100 мкл суспензии, центрифугируют при 650 об/мин в течение 5 минут. В настоящей работе для приготовления мазков жидкости БАЛ использовали цитоцентрифугу Cytospin 3 (“Life Science International”, UK). Использование цитоцентрифуги для приготовления мазков жидкости БАЛ имеет ряд преимуществ:
В мазках, окрашенных по Романовскому-Гимза, проводят подсчет различных клеточных элементов на 200 клеток. Полученные данные о процентном содержании клеток суммируют в цитограмме. Для определения абсолютного содержания различных клеточных элементов в бронхиальном и бронхоальвеолярном смыве пересчитывают полученные данные с учетом цитоза. Для бактериоскопического исследования проводят окраску по Граму.
Использование БАЛ в диагностики бронлегочной технологии
Согласно рекомендациям Рабочей группы по бронхоальвеолярному лаважу Европейского респираторного общества (4) нормальным считают следующий состав бронхиальной порции жидкости БАЛ:
Бронхиальный эпителий |
5-20% |
В том числе: |
|
Цилиндрический |
4- 15% |
Плоский |
1- 5% |
Альвеолярные макрофаги |
64- 88% |
Нейтрофилы |
5- 11% |
Лимфоциты |
2 –4% |
Тучные клетки |
0. –0.5% |
Эозинофилы |
0. -0.5% |
Использование цитобактериоскопии мазков, окрашенных по Граму, позволяет выявить и полуколичественно оценить содержание в бронхиальном смыве бактерий (с дифференцировкой их на грам-положительные и грам-отрицательные) и грибов. Эти результаты могут быть полезны при исследовании БАЛ в случае воспалительных процессов в бронхолегочном пространстве для назначения соответствующей антибактериальной терапии до получения результатов бактериологического исследования.
Нормальная цитограмма альвеолярной порции БАЛ приведена в таблице 1.
Некурящие |
Курящие |
|
Цитоз в 1 мл |
0.1 –0.3*106 |
>0.3*106 |
АМ |
82- 98% |
94% |
Лимфоциты |
7- 12% |
5% |
Нейтрофилы |
1- 2% |
0.8% |
Эозинофилы |
< 1% |
0.6% |
Тучные клетки |
<1% |
При остром воспалении или при обострении хронического процесса в легких в цитограмме БАС увеличивается доля полиморфноядерных лейкоцитов, достигая при высокой активности воспаления 90-95%. С помощью кластерного анализа большого числа наблюдений были выделены три степени активности воспаления: низкая (с содержанием нейтрофилов до 10%), умеренная (11-30%) и высокая (более 30%) (5). При бронхиальной астме увеличивается общее число нейтрофилов в БАС у 30% больных в поздней стадии и в межпристунный период, число эозинофилов варьирует в широком диапазоне, но, как правило, не превышает 18%. Цитограмма БАС, при учете других клинико-лабораторных показателей, позволяет проводить дифференциальную диагностику различных неопухолевых заболеваний ле1ких, таких как бронхиальная астма, эозинофильная пневмония, гиперчувствительный пневмонит, саркоидоз, идиопатическии фиброзирующий альвеолит, хронический бронхит в фазе обострения (6, 7). Усредненные данные основных показателей цитограммы БАС для этих заболевании приведены в таблице 2. Таким образом, цитограмма БС и ВАС имеет важное значение в дифференциально-диагностическом алгоритме при неспецифической легочной патологии.
В настоящее время считают, что БАЛ является методом выбора для диагностики:
В других случаях БАЛ позволяет ограничить дифференциальную диагностику рамками определенной группы нозологических единиц.
Клетки |
норма |
БА |
ЭП |
ГП |
С |
ИФА |
ТН |
ТА |
ХБ |
|---|---|---|---|---|---|---|---|---|---|
87 |
73 |
45 |
20 |
58 |
69 |
94 |
72 |
21 |
|
Лимфоциты |
12 |
16 |
20 |
77 |
40 |
21 |
5 |
15 |
9 |
Нейтрофилы |
0.5 |
2 |
12 |
2 |
1 |
7 |
1 |
13 |
69 |
0.5 |
9 |
23 |
1 |
1 |
3 |
- |
- |
1 |
БА - бронхиальная астма,
ЭП - эозинофильная пневмония,
ГП - гиперчувствительный пневмонит,
С - саркоидоз,
ИФА – идиопатический фиброзирующий альвеолит,
ТН - туберкулез (неактивная фаза),
ТА - туберкулез (активная фаза),
ХБ - хронический бронхит
Литература